توضیحات
آخرین آبدیت روش اجرایی مدیریت ریسک محصول ایزو 13485 در فروردین ماه 1402 توسط کارشناسان کیفیت پژوهان آریا بر اساس الزامات ISO 14971:2019 و همچنین استفاده از آخرین ویرایش استاندارد راهنمای پیاده سازی مدیریت ریسک یعنی ISO 24971:2020 انجام گردیده و جهت دانلود توسط شما کاربر گرامی قرار داده شده است.
روش اجرایی ارزیابی ریسک در این ویرایش توسعه یافته و بخش هایی از راهنمای ایزو 24971 نیز به عنوان راهنما برای اجرای فرآیند مدیریت ریسک در آن گنجانده شده است که همین امر ضمن ایجاد بهبود کیفی این سند به عنوان یک مرجع راهنما برای اجرای مدیریت ریسک محصولات پزشکی، باعث افزایش تعداد صفحات متن روش اجرایی از 12 صفحه به 42 صفحه و همچنین تعداد فرمها از یک فرم به پنج فرم افزایش یافته است.
| دانلود متن انگلیسی استاندارد ISO 14971:2019 |
تکنیک های تخمین (برآورد) ریسک در روش اجرایی مدیریت ریسک محصول در ایزو 13485
تخمین ریسک (Risk Estimation) در سیستم های مدیریت کیفیت و سایر سیستم های مدیریتی به فعالیت ارزیابی میزان وخامت(شدت) یک ریسک و همچنین تعیین احتمال وقوع ریسک در بازه های زمانی مشخص گفته می شود که از برآیند آنها یعنی ضرب شدت در احتمال وقوع، سطح ریسک یا مخاطره بدست می آید که تعیین کننده میزان آسیب و صدمه به فرد/افراد و یا سیستم است.
مطابق الزامات ISO 14971:2019 سازنده باید تکنیک مشخصی را برای تخمین ریسک در روش اجرایی مدیریت ریسک محصول ایزو 13485 تعیین نماید که استاندارد ایزو 24971 تکنیک های زیر را طی پیوست ب (Annex B) ارائه کرده است ولی هیچ کدام را الزام نموده است و انتخاب متد تخمین ریسک محصول را به سازنده واگذار نموده است ولی با این حال در بند 5.5 استاندارد 24971 2020 دو مدل 3×3 و 5×5 برای تخمین سطح ریسک از طریق تعیین میزان شدت و احتمال وقوع با مدل PHA=Preliminary Hazard Analysis ارائه کرده است که در متن روش اجرایی مدیریت ریسک هر دو مدل به همراه مدل FMEA درج کرده ایم.
Preliminary Hazard Analysis (PHA)
Fault Tree Analysis (FTA)
Event Tree Analysis (ETA)
Failure Mode and Effects Analysis (FMEA)
Hazard and Operability Study (HAZOP)
Hazard Analysis and Critical Control Point (HACCP)

تکنیک تخمین ریسک محصول با مدل FMEA
تکنیک FMEA یکی از دو مدلی است که در روش اجرایی مدیریت ریسک محصول ایزو 13485 آورده شده است که ما جهت آشنایی شما کاربران گرامی سه جدول شدت، احتمال وقوع و تشخیص را به عنوان نمونه در این صفحه قرار داده ایم که در ادامه جدول تعیین سطح ریسک را با 81 سطح ریسک که از برآیند دو پارامتر “شدت” و “وقوع” حاصل شده نیز مشاهده خواهید نمود.
در این جدول سطح ریسک قابل قبول برای یک شرکت فرضی عدد”30” ، ریسک قابل بررسی عدد”31-50” و ریسک غیر قابل قبول عدد “بزرگتر از 51” تعیین شده است که به ترتیب با رنگ های “سبز”، “زرد” و “قرمز” مشخص شده است.حال شما می توانید این سطح ریسک ها را با توجه به سیاست های شرکت خود(خط مشی تعیین سطح قابل قبول)، ویژگیهای محصول، سوابق کیفی شامل انطباق، عدم انطباق، مرجوعی، شکایت مشتری، کاربردهای محصول و غیره تعیین نمایید. در ادامه دانلود رایگان فرم ارزیابی ریسک FMEA را قرار داده ایم که می توانید آنرا دریافت نموده و با الگو گرفتن از جداول تخمین ریسک FMEA اقدام به ارزیابی ریسک محصولات سازمان خود بنمایید.
جدول شدت(S):
| ضریب | سطح | شرح |
| 10 | فاجعه بار | محصول نامنطبق مي تواند باعث خطرات بسيار جدي براي بيمار و يا اپراتور باشد. |
| 9 | ||
| 8 | وخیم | مي تواند باعث آسيب شديد و يا بيماري شديدي براي بيمار و يا اپراتور شود. |
| 7 | ||
| 6 | جدی | مي تواند باعث ايجاد حساسيت ضعيف براي بيمار و يا اپراتور بشود. |
| 5 | ||
| 4 | جزئی | مشکل خاصي براي بيمار و يا اپراتور ايجاد نمي کند ولي بايد شناسائي و پيگيري شود. |
| 3 | ||
| 2 | ناچیز | هيچ مشکلي براي بيمار و يا اپراتور ايجاد نمي کند. |
جدول احتمال وقوع(O):
| ضریب | سطح | شرح |
| 10 | مکرر | بر اساس نوع تکنولوژي و محصول غير قابل پيشگيري است و هميشگي است.
( بيشتر از 40%) |
| 9 | ||
| 8 | محتمل | احتمال وقوع عدم انطباق زياد مي باشد (40% – 6% ) |
| 7 | ||
| 6 | گاه گاه | احتمال وقوع 5% – 1% است |
| 5 | ||
| 4 | به ندرت | کمتر از 1 % مورد عدم انطباق در سال ديده ميشود. |
| 3 | ||
| 2 | غیر محتمل | تقريبا احتمال وقوع اين عدم انطباق صفر مي باشد. |
جدول تشخیص(D):
| ضریب | سطح | شرح |
| 10 | خیلی کم | هيچ کنترلي بر روي محصول جهت شناسائي عدم انطباق وجود ندارد کمتر از 2% |
| 9 | ||
| 8 | کم | احتمال شناسائي عدم انطباق بسيار ناچيز مي باشد.15% – 3% |
| 7 | ||
| 6 | نسبتاً زیاد | احتمال کمي وجود دارد که محصول نامنطبق شناسايي شود. (40% – 16% ) |
| 5 | ||
| 4 | زیاد | احتمال شناسايي محصول نامنطبق زياد و 85% – 40% مي باشد. |
| 3 | ||
| 2 | خیلی زیاد | بطور حتم و بيش از 85% محصول نامنطبق شناسايي مي شود. |
جدول تعیین سطح ریسک(RPN):
| ضریب |
مکرّر | محتمل |
گاه به گاه | به ندرت |
غیر محتمل | |||||
| 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | ||
فاجعه بار |
10 | 100 | 90 | 80 | 70 | 60 | 50 | 40 | 30 | 20 |
| 9 | 90 | 81 | 72 | 63 | 54 | 45 | 36 | 27 | 18 | |
| بحرانی |
8 | 80 | 72 | 64 | 56 | 48 | 40 | 32 | 24 | 16 |
| 7 | 70 | 63 | 56 | 49 | 42 | 35 | 28 | 21 | 14 | |
| جدی/عمده |
6 | 60 | 54 | 48 | 42 | 36 | 30 | 24 | 18 | 12 |
| 5 | 50 | 45 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | |
| جزئی |
4 | 40 | 36 | 32 | 28 | 24 | 20 | 16 | 12 | 8 |
| 3 | 30 | 27 | 24 | 21 | 21 | 15 | 12 | 9 | 6 | |
| ناچیز | 2 | 20 | 18 | 16 | 14 | 14 | 10 | 8 | 6 | 4 |
| دانلود رایگان فرم ارزیابی ریسک FMEA |
تکنیک های تجزیه و تحلیل ریسک در روش اجرایی مدیریت ریسک محصول پزشکی
تجزیه و تحلیل ریسک (Risk Evaluation) به فعالیت مقایسه مقدار ریسک تخمین داده شده با مقدار قابل قبول ریسک طبق خط مشی سازنده(سازمان) گفته می شود که طی این فعالیت میزان ریسک باقی مانده تعیین می گردد.
آیا مدیریت ریسک محصول تجهیزات پزشکی یک الزام است؟
استاندارد ایزو 13485 مطابق بند 7-1 طرحریزی تحقق محصول شرکت های فعال در حوزه تولید و ارائه تجهیزات پزشکی را ملزم نموده است که فرآِیندی را جهت مدیریت ریسک محصول و بر مبنای استاندارد ایزو 14971 ایجاد نمایند و پیش از تحویل محصول به مشتری از کاهش ریسک به سطح قابل قبول اطمینان حاصل نمایند که مطابق الزامات اداره کل تجهیزات پزشکی IMED شرکت ها باید سوابق ارزیابی ریسک محصول پزشکی خود را در پرونده فنی محصول (تکنیکال فایل) درج نموده و آنرا جهت برسی و دریافت تاییدیه به آن سازمان تحویل نماید و تا زمانی که تایید اداره کل را دریافت نموده اند اجازه تولید و عرضه محصول در بازار را ندارند.
| دانلود متن انگلیسی استاندارد ISO 24971:2020 |
الزامات مدیریت ریسک محصول ایزو 13485
7- تحقق محصول
7-1-طرحریزی تحقق محصول
سازمان باید فرایندهای موردنیاز برای تحقق محصول را طرحریزی نموده و توسعه دهد. طرحریزی تحقق محصول باید سازگار با الزامات دیگر فرایندهای سیستم مدیریت کیفیت باشد.
سازمان باید یک یا چند فرایند را برای مدیریت ریسک در تحقق محصول, مدون نماید. سوابق به دست آمده از مدیریت ریسک باید نگهداری شوند. (4-2-5 را ببینید).
در طرحریزی تحقق محصول, سازمان باید موارد زیر را در صورت اقتضا، تعیین نماید:
آ)اهداف کیفیت و الزامات مربوط به محصول,
ب)نیاز به استقرار فرایندها و مدارک (4-2-4 را ببینید) و فراهم آوری منابع خاص محصول شامل زیرساخت ها و محیط کاری.
پ)فعالیت های الزامیِ تصدیق , صحه گذاری, پایش, بازرسی و آزمون, جابجایی، انبارش، توزیع و ردیابی خاصِ محصول به همراه معیارهای پذیرش محصول,
ت)سوابق موردنیاز برای ارائه ی شواهدی که فرایندهای تحقق و محصول به دست آمده، الزامات را برآورده می کنند (4-2-5 را ببینید),
بروندادهای طرحریزی باید به شکلی مناسبی در تناسب با روش های عملیات سازمان باشد.
یادآوری: اطلاعات بیشتر در ISO14971 یافت می شود.
انتشار ویرایش جدید استاندارد مدیریت ریسک محصول در سیستم مدیریت کیفیت تجهیزات پزشکی
همانطور که می دانید آخرین ویرایش استاندارد مدیریت ریسک در تجهیزات پزشکی ایزو 14971 در سال 2019 صورت گرفته که نسبت به نسخه قبلی یک سری تغییرات پیدا نموده است و همین موضوع باعث شد تا شرکت ها اقدام به بازنگری روش اجرایی ارزیابی و مدیریت ریسک محصول نمایند چرا که در ممیزی های داخلی و همچینن ممیزی های صدور گواهینامه ISO 13485:2016 انطباق فرآیند مدیریت ریسک محصول با الزامات ISO 14971:2019 به عنوان الزام شناخته می شود که در صورت عدم ارائه شواهد دال بر اجرای فرآیند ارزیابی ریسک مطابق استاندارد 14971 ویرایش 2019 و عدم تصدیق یا پذیرش آن توسط آدیتور(Auditor) نشان دهنده عدم برآورده سازی این الزام بوده که منجر به صدور عدم انطباق (NC:Nonconformity) برای شرکت ها می گردد.
تحلیل ریسک- منفعت
یکی از تغییرات اساسی استاندارد ISO 14971 در ویرایش 2020 ، الزام محاسبه منفعت(مزایای) استفاده یا بکارگیری تجهیز پزشکی در مقابل ریسک باقی مانده می باشد بدین معنی زمانیکه برای ریسک باقی مانده فراتر از معیار پذیرش انجام اقدامات اصلاحی و پیشگیرانه مقدور نباشد، سازنده می باید مزایای استفاده از تجهیز را آنالیز نماید و اثبات کند که مزایای استفاده و یا بکارگیری تجهیز بیشتر میزان آسیب یا زیان احتمالی استفاده از تجهیز پزشکی است در غیر اینصورت یا باید وسیله پزشکی را تغییر دهد یا کاربرد/استفاده آنرا در غیر اینصورت ریسک غیر قابل قبول باقی می ماند.
جدول مقایسه تغییرات ایزو 14971 نسبت به ویرایش قبلی این استاندارد
| ISO 14971:2007 | ISO 14971:2019 |
| مقدمه | مقدمه |
| 1 دامنه | 1 دامنه |
| بند جدید | 2 مراجع قانونی |
| 2 اصطلاحات و تعاریف | 3 اصطلاحات و تعاریف |
| 2.1 سند همراه(پیوست) | 3.1 سند همراه(پیوست) |
| بند جدید | 3.2 منفعت |
| 2.2 آسیب | 3.3 آسیب |
| 2.3 خطر | 3.4 خطر |
| 2.4 وضعیت خطرناک | 3.5 وضعیت خطرناک |
| 2.5 استفاده مورد نظر | 3.6 استفاده مورد نظر |
| 2.6 دستگاه پزشکی تشخیصی آزمایشگاهی دستگاه پزشکی IVD | 3.7 دستگاه پزشکی تشخیصی آزمایشگاهی دستگاه پزشکی IVD |
| 2.7 چرخه حیات | 3.8 چرخه حیات |
| 2.8 سازنده | 3.9 سازنده |
| 2.9 دستگاه پزشکی | 3.10 دستگاه پزشکی |
| 2.10 شواهد عینی | 3.11 شواهد عینی |
| 2.11 پس از تولید | 3.12 پس از تولید |
| 2.12 روش (اجرایی) | 3.13 روش (اجرایی) |
| 2.13 فرآیند | 3.14 فرآیند |
| بند جدید | 3.15 استفاده نادرست منطقی قابل پیش بینی |
| 2.14 سوابق | 3.16 سوابق |
| 2.15 ریسک باقیمانده | 3.17 ریسک باقیمانده |
| 2.16 خطر(ریسک) | 3.18 خطر(ریسک) |
| 2.17 تجزیه و تحلیل ریسک | 3.19 تجزیه و تحلیل ریسک |
| 2.18 ارزشیابی ریسک | 3.20 ارزشیابی ریسک |
| 2.19 کنترل ریسک | 3.21 کنترل ریسک |
| 2.20 برآورد(تخمین) ریسک | 3.22 برآورد(تخمین) ریسک |
| 2.21 ارزیابی ریسک | 3.23 ارزیابی ریسک |
| 2.22 مدیریت ریسک | 3.24 مدیریت ریسک |
| 2.22 پرونده مدیریت ریسک | 3.25 پرونده مدیریت ریسک |
| 2.24 ایمنی | 3.26 ایمنی |
| 2.25 شدت | 3.27 شدت |
| بند جدید | 3.28 آخرین دستاوردهای علمی |
| 2.26 مدیریت ارشد | 3.29 مدیریت ارشد |
| 2.27 خطای استفاده | 3.30 خطای استفاده |
| 2.28 تأیید | 3.31 تأیید |
| 3 الزامات عمومی برای مدیریت ریسک | 4 الزامات عمومی برای سیستم مدیریت ریسک |
| 3.1 فرآیند مدیریت ریسک | 4.1 فرآیند مدیریت ریسک |
| 3.2 مسئولیت های مدیریت | 4.2 مسئولیت های مدیریت |
| 3.3 صلاحیت کارکنان | 4.3 شایستگی کارکنان |
| 3.4 طرح مدیریت ریسک | 4.4 طرح مدیریت ریسک |
| 3.5 پرونده مدیریت ریسک | 4.5 پرونده مدیریت ریسک |
| 4 تجزیه و تحلیل ریسک | 5 تجزیه و تحلیل ریسک |
| 4.1 فرآیند تحلیل ریسک | 5.1 فرآیند تحلیل ریسک |
| 4.2 استفاده مورد نظر و شناسایی ویژگی های مربوط به ایمنی دستگاه پزشکی | 5.2 استفاده مورد نظر و استفاده نادرست منطقی قابل پیش بینی |
| 5.3 شناسایی ویژگی های مربوط به ایمنی | |
| 4.3 شناسایی خطرات | 5.4 شناسایی خطرات و موقعیت های خطرناک |
| 4.4 تخمین خطر(های) برای هر موقعیت خطرناک | 5.5 تخمین ریسک |
| 5 ارزیابی ریسک | 6 ارزیابی ریسک |
| 6 کنترل ریسک | 7 کنترل ریسک |
| 6.1 کاهش ریسک | زیر بند حذف شده |
| 6.2 تجزیه و تحلیل گزینه کنترل ریسک | 7.1 تجزیه و تحلیل گزینه کنترل ریسک |
| 6.3 اجرای اقدامات کنترل ریسک | 7.2 اجرای اقدامات کنترل ریسک |
| 6.4 ارزیابی ریسک باقیمانده | 7.3 ارزیابی ریسک باقیمانده |
| 6.5 تجزیه و تحلیل ریسک/منفعت | 7.4 تجزیه و تحلیل منفعت-ریسک |
| 6.6 خطرات ناشی از اقدامات کنترل ریسک | 7.5 خطرات ناشی از اقدامات کنترل ریسک |
| 6.7 کامل بودن کنترل ریسک | 7.6 کامل بودن کنترل ریسک |
| 7 ارزیابی پذیرش کلی ریسک باقیمانده | 8 ارزیابی ریسک باقیمانده کلی |
| 8 گزارش مدیریت ریسک | 9 بازنگری مدیریت ریسک |
| 9 اطلاعات تولید و پس از تولید | 10 فعالیت های تولیدی و پس از تولید |
| 10.1 کلیات | |
| 10.2 جمع آوری اطلاعات | |
| 10.3 بازنگری اطلاعات | |
| 10.4 اقدامات | |
| ضمیمه الف دلایل برای الزامات | ضمیمه الف دلیل برای الزامات |
| ضمیمه B مروری بر فرآیند مدیریت ریسک برای دستگاه های پزشکی | پیوست B فرآیند مدیریت ریسک برای تجهیزات پزشکی |
| ضمیمه C سؤالاتی که می توانند برای شناسایی ویژگی های دستگاه پزشکی که می توانند بر ایمنی تأثیر بگذارند استفاده شوند | Moved to ISO/TR 24971 |
| ضمیمه D مفاهیم خطر اعمال شده در دستگاه های پزشکی | |
| پیوست E نمونه هایی از خطرات، توالی قابل پیش بینی رویدادها و موقعیت های خطرناک | به ISO/TR 24971 منتقل شد |
| ضمیمه F طرح مدیریت ریسک | به ISO/TR 24971 منتقل شد |
| پیوست G اطلاعات در مورد تکنیک های مدیریت ریسک | |
| راهنمای ضمیمه H در مورد مدیریت خطر برای دستگاه های پزشکی تشخیصی آزمایشگاهی | |
| ضمیمه I راهنمای فرآیند تجزیه و تحلیل ریسک برای خطرات بیولوژیکی | (ضمیمه حذف شد) |
| ضمیمه J اطلاعات ایمنی و اطلاعات مربوط به ریسک باقیمانده | Moved to ISO/TR 24971 |
| کتابشناسی – فهرست کتب(مراجع) | کتابشناسی – فهرست کتب(مراجع) |
بازنگری روش اجرایی مدیریت ریسک محصول در استاندارد ایزو 13485
با توجه به توضیحات فوق شما باید روش اجرایی مدیریت ریسک محصول ISO 14971 در سیستم مدیریت تجهیزات پزشکی خود را با بر اساس الزامات جدید ایزو 14971 به روز نمایید و این مسئله را هم مد نظر داشته باشید که استاندارد راهنمای پیاده سازی مدیریت ریسک یعنی استاندارد ISO 24971 نیز در سال 2020 ویرایش داشته و شما باید از آخرین نسخه آن یعنی ISO 24971:2020 استفاده نمایید.

الزامات استاندارد ایزو 14971 ویرایش 2019
بند 3 تعاریف
تعاریف در این روش اجرایی بر اساس تعاریف ارائه شده در ایزو 14971 ویرایش 2019 است:
مستندسازی همراه
مواد (اطلاعات) همراه تجهیز پزشکی (3.10) و شامل اطلاعاتی برای کاربر و آنهایی که مسئول نصب، استفاده، نگهداری، دمونتاژ و امحای تجهیز پزشکی(3.10) به خصوص از نظر استفاده ی ایمن هستند.
- سود (benefit)
تأثیر مثبت یا نتیجه مطلوب استفاده از یک دستگاه پزشکی (3.10) بر سلامت یک فرد، یا تأثیر مثبت بر مدیریت بیمار یا سلامت عمومی.
- صدمه (harm)
آسیب (جرح) یا خسارت (زیان) وارده به بیمار، یا خسارت وارده به اموال یا محیط.
- خطر (hazard)
منبع بالقوه ی صدمه.
- وضعیت خطرناک (hazardous situation)
شرایطی که در آن، افراد، اموال یا محیط در معرض یک یا چند خطر قرار می گیرند.
- کاربرد موردنظر
استفاده از محصول، فرایند یا خدمت که مطابق مشخصات، دستورالعمل ها و اطلاعات ارائه شده توسط سازنده، در نظر گرفته شده است، مورد استفاده قرار گیرد.
- دستگاه پزشکی تشخیصی آزمایشگاهی دستگاه پزشکی IVD
دستگاهی، چه به تنهایی و چه به صورت ترکیبی مورد استفاده سازنده (3.9) برای بررسی آزمایشگاهی نمونه های مشتق شده از بدن انسان صرفاً یا اصولاً برای ارائه اطلاعات برای اهداف تشخیصی، نظارت یا سازگاری و از جمله معرف ها، کالیبراتورها، مواد کنترلی، ظروف نمونه، نرم افزار، و ابزار یا دستگاه های مرتبط یا سایر اقلام
- چرخه حیات
مجموعه ی تمامی مراحل در حیات یک تجهیز پزشکی (3.10) از مفهوم سازی اولیه تا دمونتاژ و امحای نهایی.
- سازنده
شخص حقیقی یا حقوقی که مسئولیت طراحی و/یا ساخت یک دستگاه پزشکی (3.10) را به قصد در دسترس قرار دادن دستگاه پزشکی (3.10) برای استفاده تحت نام خود دارد، خواه چنین وسیله پزشکی (3.10) توسط خود آن شخص یا از طرف او توسط شخص یا اشخصاص دیگری طراحی و یا ساخته شده باشد یا نباشد.
- تجهیزات پزشکی
ابزار، دستگاه، افزار، ماشین، وسیله، ایمپلنت، معرف(موضوع) برای استفاده در شرایط آزمایشگاهی، نرم افزار، مواد یا سایر محصولات مشابه یا مرتبط، که توسط سازنده (3.9) برای استفاده به تنهایی یا ترکیبی، برای انسان، برای یک مورد یا بیشتر از اهداف پزشکی خاص در نظر گرفته شده است.
– تشخیص، پیشگیری، نظارت، درمان یا کاهش بیماری،
– تشخیص، نظارت، درمان، کاهش یا جبران آسیب،
– بررسی، جایگزینی، اصلاح یا پشتیبانی آناتومی یا یک فرآیند فیزیولوژیکی،
– حمایت یا حفظ حیات،
– کنترل لقاح
– ضد عفونی وسایل پزشکی (3.10)
– ارائه اطلاعات از طریق بررسی آزمایشگاهی نمونههایی که از بدن انسان به دست میآیند و عملکرد مورد نظر اولیه خود را با روشهای دارویی، ایمونولوژیکی یا متابولیک در بدن یا روی بدن انسان به دست نمیآورند، اما ممکن است چنین وسایلی به عملکرد آن کمک کنند.
- شواهد عینی
داده های پشتیبانی کننده ی وجود یا تنوع چیزی.
- پس از تولید
بخشی از چرخه ی حیات تجهیز پزشکی که محصول طراحی شده و ساخته شده است.
مانند: حمل و نقل، انبارش، نصب، استفاده از تجهیز، نگهداری، تعمیرات، تغییرات محصول، دمونتاژ و امحا.
- روش اجرایی
روش مشخص شده برای انجام یک فعالیت یا یک فرآیند (3.14)
- فرآیند
مجموعه ای از فعالیت های مرتبط یا متقابل که از ورودی ها برای ارائه یک نتیجه مورد نظر استفاده می کنند.
- استفاده ی نادرستِ معقول و قابل پیش بینی
استفاده از محصول یا سیستم به شکلی که موردنظر سازنده نیست ولی از رفتار قابل پیش بینی انسانی، می تواند به وجود آید.
- سوابق
سندی که نتایج به دست آمده یا ارائه شواهدی از فعالیت های انجام شده را بیان می کند.
- ریسک باقی مانده
ریسکهایی که پس از پیاده سازی معیارهای کنترل ریسک، باقی مانده اند.
- ریسک
ترکیب از احتمال وقوع آسیب (3.3) و شدت آسیب (3.27).
- تحلیل ریسک
استفاده ی سیستماتیک از اطلاعات موجود برای شناسایی خطرات (3.4) و برآورد ریسک(3.18).
- ارزیابی ریسک
فرایند کلی (3.14) شامل تجزیه و تحلیل ریسک(3.19) و ارزیابی ریسک(3.20).
- کنترل ریسک
فرایندی که در آن تصمیماتی گرفته شده و اقداماتی پیاده سازی می گردد که طی آن ریسک ها به سطوح مشخص شده کاهش یافته و یا در سطوح مشخص شده، حفظ می شوند.
- برآورد ریسک
به فرایند (3.14) مورد استفاده برای تخصیص مقادیر به احتمال وقوع آسیب (3.3) و میزان شدت (3.27) آسیب.
- ارزیابی ریسک (Risk Evaluation)
فرایند مقایسه ی ریسک های تخمینی(3.18) با معیارهای داده شده (3.18)به ریسک برای تعیین قابل قبول بودن ریسک.
- مدیریت ریسک
کاربرد سیستماتیک خط مشی های مدیریتی، روش های مدیریتی(3.13) و شیوه ها برای وظایف تحلیل، ارزیابی، کنترل و پایش ریسک(3.18).
- پرونده ی مدیریت ریسک
مجموعه ای از سوابق (3.16) و دیگر اسنادی که به توسط مدیریت ریسک، ایجاد شده اند(3.24).
- ایمنی
رهایی از ریسک های غیرقابل قبول(3.18).
- شدت
میزان پیامدهای احتمالی یک خطر(3.4).
- State of the Art (آخرین دستاوردهای علمی)
مرحله ی توسعه یافته توانایی فنی در یک زمان معین در خصوص محصولات، فرایندها(3.14) و خدمات بر اساس یافته های تلفیقی علم، فناوری و تجربه.
- مدیریت ارشد
شخص یا گروهی از افرادی که یک سازنده (3.9) را در بالاترین سطح هدایت و کنترل می کنند.
- خطای استفاده(کاربرد)
اقدام کاربر یا فقدان اقدام کاربر در زمان استفاده تجهیز که منجر به نتیجه ای متفاوت از آن چه که سازنده درنظر گرفته یا کاربر انتظار داشته، شده است.
- تصدیق
تایید برآورده شدن الزامات مشخص شده، از طریق ارائه ی شواهد عینی(3.11).
اساس مفهوم ریسک محصول تجهیزات پزشکی در ایزو 14971 2019
شکل زیر اساس مفهومی ریسک را که چگونه احتمالا یک موقعیت خطرناک که می تواند منجر به آسیب (harm) شود که خود نتیجه و پیامد رویداد های است که تابع دو موئلفه شدت رویداد و احتمال وقوع رویداد است.
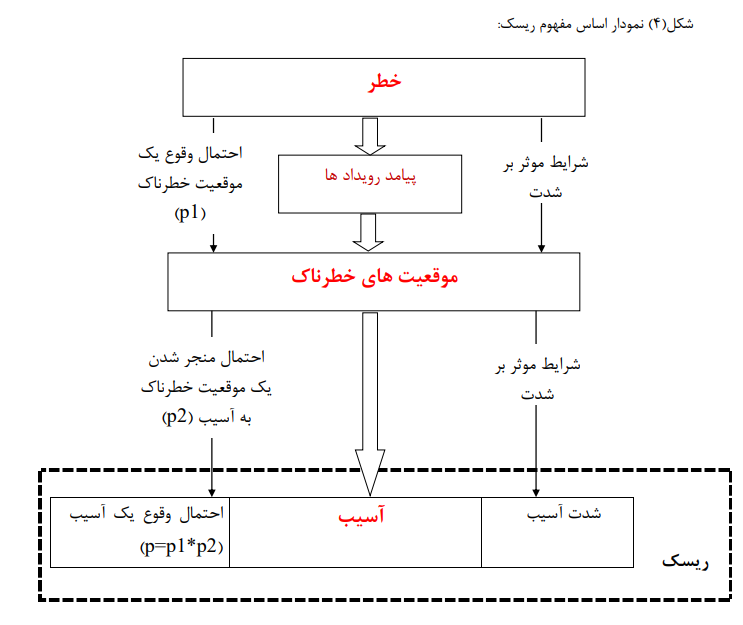
فرآیند مدیریت ریسک محصول ISO 14971:2019
در راستای عملیاتی نمودن روش اجرایی مدیریت ریسک محصول ایزو 13485 و تشکیل پرونده پزشکی (Technical file) بهتر است مدل فرآیندی زیر را سرلوحه فعالیت های خود قرار دهید تا چیزی از قلم نیافتد و از این طریق بند های الزامی ایزو 14971 را در مدیریت ریسک پوشش دهید و بعد ها برای دریافت تاییدیه تکنیکال فایل از اداره کل تجهیزات پزشکی IMED در حوزه ارزیابی ریسک و اقدامات صورت گرفته مشکلی نداشته باشید.
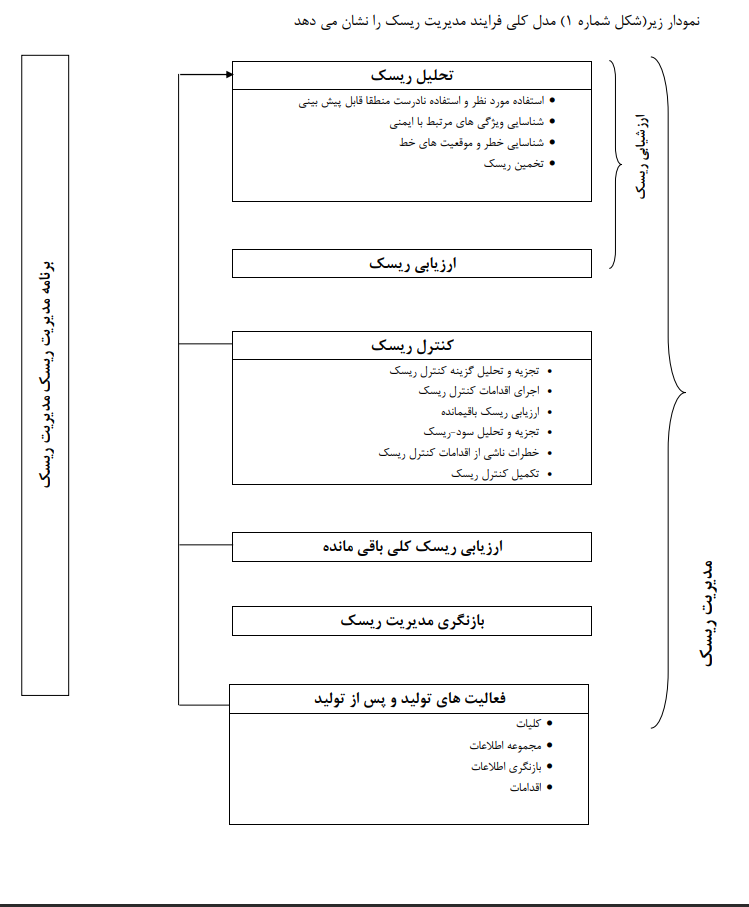
دانلود روش اجرایی مدیریت ریسک محصولات در تجهیزات پزشکی ایزو 14971
شما با دریافت این روش اجرایی به راحتی قادر خواهید بود ضمن اجرای کلی مدیریت ریسک محصول، ارزیابی ریسک دستگاه پزشکی خود را به انجام برسانید و اطلاعات لازم برای تکمیل پرونده فنی محصول یعنی تکنیکال فایل آماده نمایید لذا فقط کافیست فایل زیپ روش اجرایی را از بخش دانلود مستندات ایزو و در گروه روش های اجرایی ایزو 13485 دانلود و سپس آن را با نرم افزار RAR یا ZIP در سیستم خود اکسترکت نمایید که شامل متن روش اجرایی، صفحه روی جلد و 5 فرم جهت اجرای ارزیابی و مدیریت ریسک محصول پزشکی است.
 شرکت کیفیت پژوهان آریا مشاور سیستم های مدیریت کیفیت، ایمنی و
شرکت کیفیت پژوهان آریا مشاور سیستم های مدیریت کیفیت، ایمنی و




نقد و بررسیها
هنوز بررسیای ثبت نشده است.